脱落细胞里都有啥
接触痕是法医实践中最常见的微量样本种类之一,在此前的文章中,我们介绍了法医科学家们对接触DNA来源探索的部分努力(脱落细胞?接触DNA从哪里来?)。但受限于当时的技术水平,以形态学为主的研究限制了结果的适用范围和说服力。近年来,成熟的现代生物学技术越来越多的在法医学领域得以应用,而法医科学家们也始终没有忽视对于接触痕、脱落细胞的进一步探索。2020年,伦敦国王学院的研究团队发表题为Illuminating touch deposits throughcellular characterization of hand rinses and body fluids with nucleic acidfluorescence的文章,通过流式细胞术和显微镜观察,研究了手部接触脱落物的组成。
根据前人的文献,接触DNA的来源可能十分多样化:一方面,尽管脱落的角质细胞不含细胞核,但细胞外仍可能有游离的DNA的存在;另一方面,碎片化、降解的细胞也可能释放游离的细胞核;最后,接触脱落物也可能并非源自手上,而是手与其他更丰富的有核细胞源(如鼻子,眼睛或嘴巴)接触后积累在手上的。多样的来源使得实际样本过于复杂、不可控,因而本次研究选取了5种受控的单一来源模拟接触脱落物:
未洗过的手:志愿者用无菌PBS轻轻擦洗未清洗过的手,每次2ml,共6ml。将擦洗后的液体收集在无菌称量皿中,并转移至1.5ml离心管中。
洗过的手:志愿者用肥皂洗手,并在自来水中彻底冲洗1-2分钟,然后避免接触,风干。重复上一类样品的收集流程。
唾液:志愿者在收集前至少1小时不吃不喝,用水短暂漱口后让唾液在嘴中积聚几分钟。这样做是为了最大程度地减少刮擦的颊细胞,而将收集的重点放在最有可能出现在可转移唾液中的细胞上。随后在无菌称量皿中收集3ml唾液,并用3mlPBS稀释。
鼻腔灌洗液:志愿者使用无菌一次性移液器,将每次2ml总共6ml的PBS加入自己的鼻腔(两个鼻孔)中,在研究人员的指导下进行鼻灌洗。在液体离开鼻腔、与外部皮肤接触之前,将其收集在无菌称量皿中。
洗眼液:志愿者使用无菌洗眼杯,用每次2ml总共6ml的PBS洗睁开的右眼,收集液体转移到1.5ml离心管中
将每种样品用以下每种条件染色:噻唑橙(TO,84nmol/L),碘化丙啶(PI,2.15μmol/L),DiamondDye(DD,1X),组合的TO/PI(84nmol/LTO,2.15μmol/LPI)。TO是一种可渗透细胞的花青染料,而PI则不会渗透到活的、完整的细胞中。两者都将在核酸结合后发出荧光,并广泛用于显微镜和流式细胞仪中。一起使用时,可以区分活细胞和死细胞,或完整细胞和受损细胞。DD是一种DNA结合染料,用于检测电泳凝胶中的核酸。
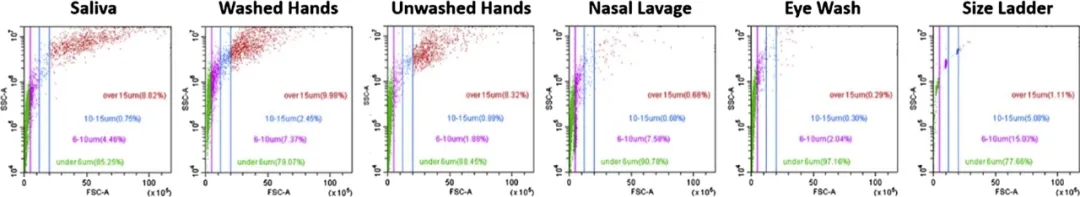
图1. 在流式细胞仪上单个样本的每种样品类型的FSC v. SSC图。X轴表示前向散射(大小),Y轴表示侧向散射(粒度)。大小按色彩分类(绿色:6μm以下,粉红色:6–10μm,蓝色在10-15μm,红色:在15μm以上)。
所有样品类型均显示出高密度的小、低粒度事件,说明有大量碎片;然后是分布更大的大粒度事件,反映完整的细胞。图1可见接触脱落物中,既有完整细胞大小(15–50μm),也有更小的(通常低于10μm)细胞碎片、体液中的游离细胞核、白细胞等。
图1中唾液、洗过的手和未洗过的手都包含相对较大的细胞群,而洗眼和洗鼻样本的大型细胞数量较低,且总体细胞密度较低,这可能是由于收集这些样品时缺乏摩擦所致。而同样摩擦少的唾液细胞密度更高,可能表明口腔粘膜比鼻子或眼睛更容易脱落细胞。
总体而言,单一样本的细胞分布差别不够大,不足以通过细胞分布来揭示复杂的脱落沉积物的主要来源。
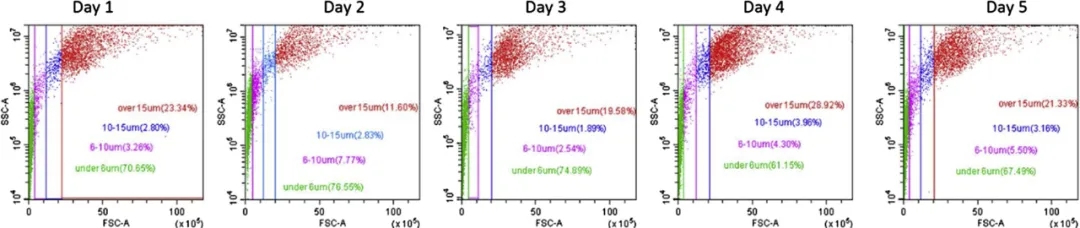 图2. 同一名志愿者5天中洗过的手样本的FSC v. SSC图。
图2. 同一名志愿者5天中洗过的手样本的FSC v. SSC图。
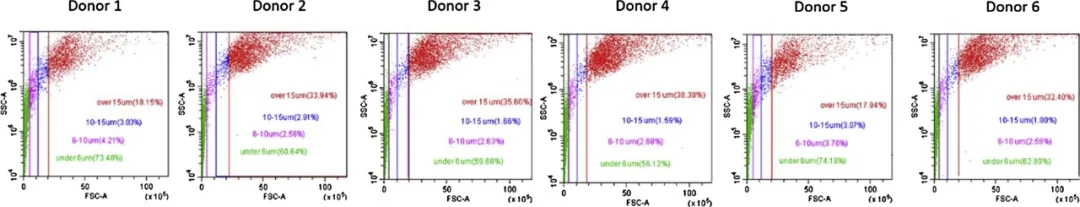
图3. 6名志愿者洗过的手样本的FSC v. SSC图。
为了评估每日变化对每个被检查的体液中单个细胞脱落的影响,在5天中分别采样,所有样本没有显著差异(p>0.05)。而在不同个体中,大于15μm的大细胞事件的百分比范围从7.4%至57.2%,任何两个捐赠者的大细胞群体百分比之间的最大差异平均值为30.9%,这比每个个体中最大差异的平均值高18.9%,但仍没有达到统计学显著差异(p=0.12)。
使用荧光核酸染料来定位样品中的DNA,即确定哪些大小的细胞或片段包含遗传物质。荧光强度高于未染色对照样品的测量自身荧光强度的任何颗粒或细胞即认为是“ DNA(+)”,因为它们的荧光表明存在核酸。
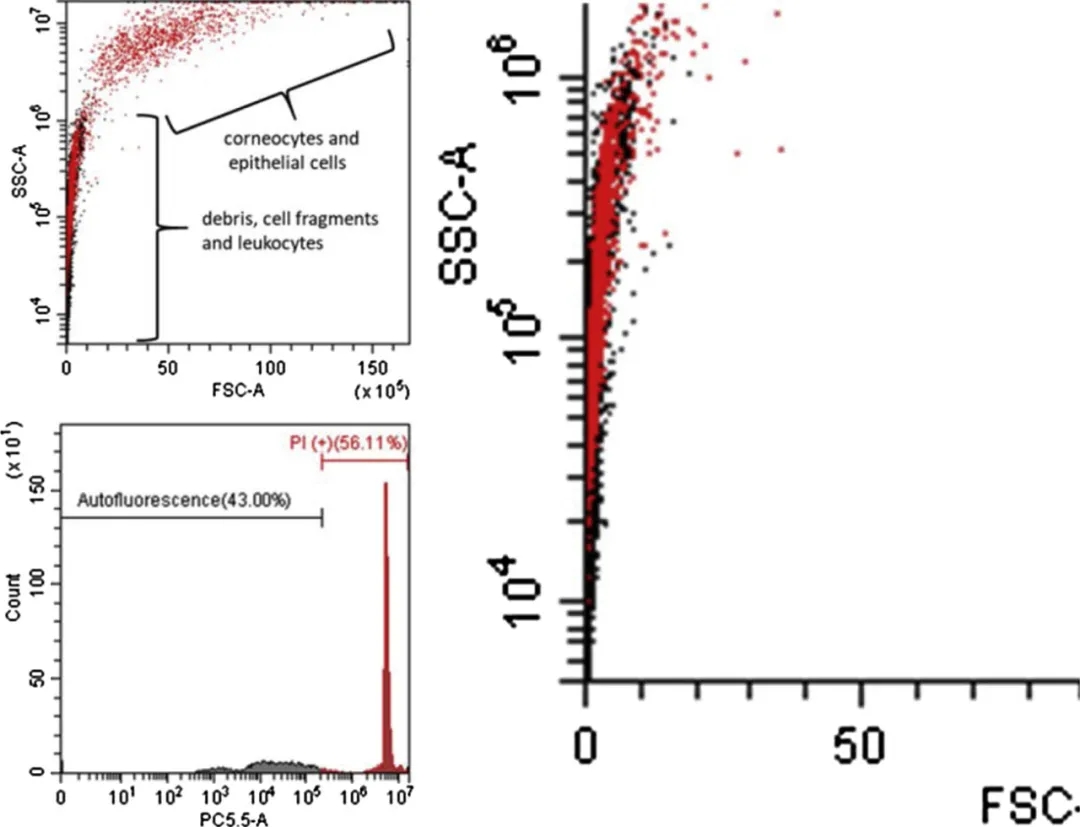 图4. PI染色的唾液的FSC v. SSC图(左上)显示了角质形成细胞簇(>15μm)和白细胞/碎片(<10μm)。红色表示检测到的核酸荧光高于黑色(左下)所示的自然自发荧光水平。特写(右)显示唾液中存在DNA+事件,与白细胞、保留DNA的降解细胞或游离核一致。
图4. PI染色的唾液的FSC v. SSC图(左上)显示了角质形成细胞簇(>15μm)和白细胞/碎片(<10μm)。红色表示检测到的核酸荧光高于黑色(左下)所示的自然自发荧光水平。特写(右)显示唾液中存在DNA+事件,与白细胞、保留DNA的降解细胞或游离核一致。
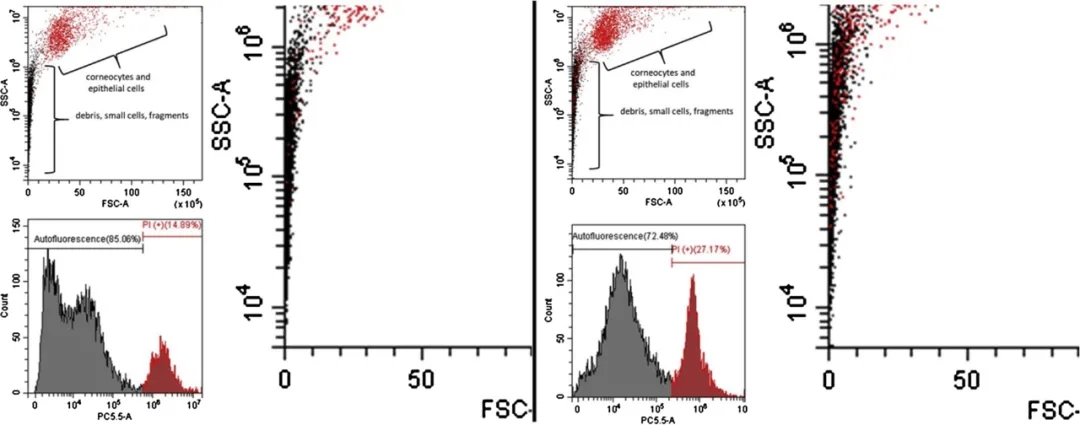
图5. 左:PI染色的洗过的手样本的FSC v. SSC图(左上)显示角质形成细胞簇(>15μm)和白细胞/碎片(<10μm)。红色表示检测到的核酸荧光高于黑色(左下)所示的自然自发荧光水平。特写(右)显示很少的DNA+事件。
右:未洗过的手样本的分布和荧光图相同。特写(右)显示出有限的含核酸碎片,比唾液中可观察到的碎片要少得多,比洗过的手样本多。
所有样本都做了核酸染色,其中洗过的手对接触脱落物的含量信息最多,而唾液有望包含全部潜在的DNA来源(即完整的有核细胞,无核角质细胞,小白细胞,游离核和降解的细胞片段)。
对于唾液样本,TO不仅染色了角质形成细胞(>15μm),还对大部分小细胞/碎片(6-15μm)进行了染色,这可能是由于存在大量白细胞。PI染色则表明大多数细胞被破坏且含有DNA。
而对于洗过的手样本,其DNA+几乎完全位于大细胞大小区域中。在PI或TO染色的小细胞/片段大小范围内几乎没有DNA+事件发生(图5)。这表明洗手液中游离核或含有DNA的细胞碎片的发生率受到限制。
有趣的是,在洗过的手和未洗过的手中都观察到了相似的结果,表明手上并没有积累很多富含DNA的生物材料,接触DNA实际上可能是无细胞的游离DNA或由完整的细胞(如无核角质细胞)提供。
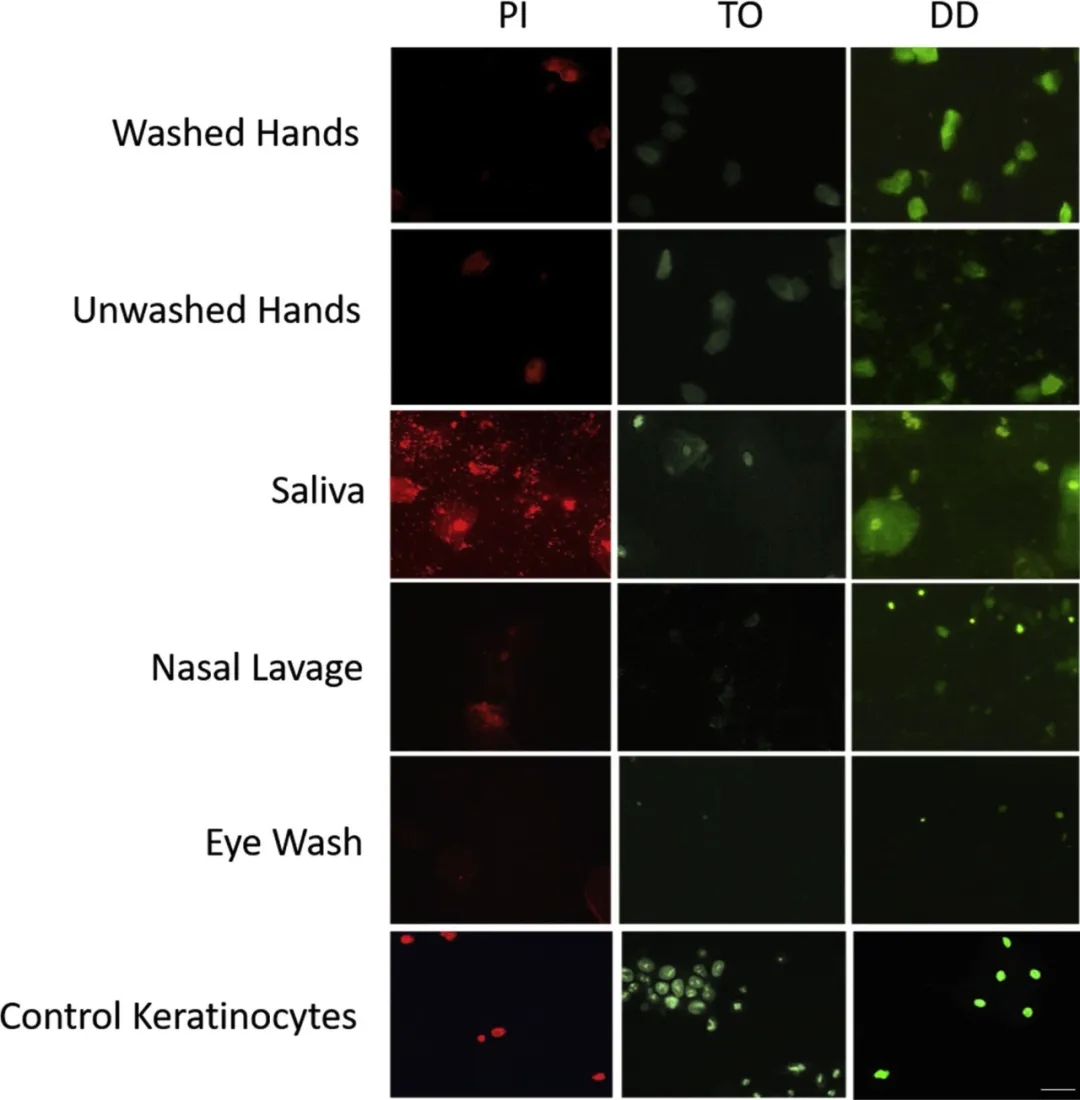 图6. 六种样品类型(从上至下:洗手、未洗手、唾液、洗鼻液、洗眼液,阳性对照:培养的角质形成细胞)用三种核酸染料染色(从左至右:碘化丙啶,噻唑橙、DiamondDye)。样品以200×检查。比例尺代表30μm。
图6. 六种样品类型(从上至下:洗手、未洗手、唾液、洗鼻液、洗眼液,阳性对照:培养的角质形成细胞)用三种核酸染料染色(从左至右:碘化丙啶,噻唑橙、DiamondDye)。样品以200×检查。比例尺代表30μm。
显微镜观察洗过的和未洗过的手样本显示出大量的双荧光无核角质细胞,它们也存在于唾液中,很少出现在洗眼液和洗鼻液中。有核上皮细胞仅在唾液中完全可见。鼻腔灌洗显示偶有角质细胞和一些不规则的荧光,可能是具有弥散性核酸的粘液;在两个样品中,DiamondDye观察到小的明亮的白细胞。洗眼液包含的细胞很少(与流式细胞术一致),仅包含稀有的荧光颗粒。当在洗眼液和洗鼻液中看到荧光时,它通常是很小的颗粒或广泛的低强度涂片,而不是可识别的细胞。
在显微镜下观察到的任何角质细胞中都缺乏核,然而这些无核细胞确实对多种核酸染料的DNA呈阳性。脱落的角质细胞的角质包膜似乎不能防止PI染色。这可能是因为角质细胞死亡并脱落,因此它们的膜是可渗透的。另一种可能性是,角质细胞的核酸染色反映了小的、膜结合的DNA片段的存在,这些片段可能是从汗液中存在的游离DNA中结合的。
流式细胞术的数据和显微镜观察到的角质细胞中的DNA+染色结果,揭示了无核细胞含有大量DNA。终末分化期,间核和其他细胞器(尤其是包含DNA的线粒体)的降解可能会在角质细胞内留下残留的核酸。需要注意的是,这些DNA和无细胞游离DNA一样,可能存在高度片段化的情况,对于标准法医STR完整扩增贡献有限,但其丰富的含量完全值得通过其方法(例如SNP)加以利用,使其成为接触DNA证据有价值的附加来源。
流式细胞术在小细胞/碎片大小的数据表面,尽管碎片是接触脱落物中占据较大比例,但它并不包含大量的DNA阳性碎片细胞或游离核。尽管在显微镜下检查的样本可能没有捕获到所有DNA(+)细胞片段,但这些数据表明碎片对接触沉积物的DNA含量贡献有限。因此,在DNA提取中过滤、除杂的过程中,即使将分离尺径缩小至6-15μm也几乎不会增加DNA损失的风险。
原文链接:
https://doi.org/10.1016/j.fsigen.2020.102269

 中文
中文 English
English



